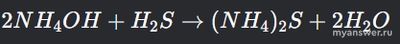Как решить задачу по химии на нахождение массовой доли?
Избыток сероводорода пропущен через 0,45 л 5,5М раствора гидрата аммиака (пл.0,95 г/мл). Найдите массовую долю (в %) соли в конечном растворе.
Ответы (1)
Логично, что для решения задачи по химии сначала нужно написать уравнение реакции:
Из уравнения видно, что из 2 молей гидрата аммиака образуется 1 моль соли (сульфида аммония), т.е. в 2 раза меньше.
Мы находим количество молей гидрата аммиака, которое у нас имеется по условиям задачи с использованием формулы:
n = C*V;
n (NH4OH) = 5,5моль/л * 0,45л = 2,475моль
Далее находим количество молей сульфида аммония, а его должно быть в 2 раза меньше, как мы упоминали выше:
n (сульфида аммония) = 2,475моль/2 = 1,2375моль.
С использованием формулы m=M*n найдем массу сульфида аммония. Количество вещества (n) мы уже нашли, теперь найдем молярную массу (М) сульфида аммония:
М = 2*(14+4*1)+32 = 68г/моль.
Подставляем данные в формулу:
m (сульфида аммония) = 68г/моль*1,2375моль= 84,15г.
Далее, чтобы найти массовую долю сульфида аммония, используем формулу:
w (массовая доля сульфида аммония)= m (масса сульфида аммония) / m (масса раствора) * 100%
В этой формуле нам неизвестна масса раствора. Находим исходя из условия задачи по формуле:
m (раствора) = p(плотность)*V(объем)
m (раствора) = (0,95г/мл * 1000) * 0,45л= 427,5г. (при рассчете привели в соответствие мл. и л.)
Теперь считаем массовую долю соли (сульфида аммония):
w (сульфида аммония) = 84,15г / 427,5 г * 100% = 19,68 %.
Ответ: Массовая доля соли (сульфида аммония) 19,68%.